前列腺癌(PCa)是全球男性中最常见的恶性肿瘤之一,其肿瘤微环境(TME)具有显著的免疫抑制特性,是一种典型的免疫“冷”肿瘤。这种“冷免疫”状态主要表现为肿瘤内T细胞浸润稀少,且免疫抑制性的肿瘤相关巨噬细胞(TAM)占比高,导致免疫检查点疗法(ICB)在前列腺癌中疗效不佳;其背后的机制一直是本领域的研究热点。
近年来我国前列腺癌发病率呈逐年上升趋势。雄激素剥夺治疗(ADT)是目前的一线疗法,起初对大多数患者有效;但癌症复发不可避免,几乎所有的患者都在1-2年内以去势抵抗性前列腺癌(CRPC)的形式复发。东南大学附属中大医院泌尿外科主任医师许斌团队长期致力于促癌蛋白YY1(Yin Yang1)及其相关通路在前列腺癌抗雄治疗抵抗及免疫微环境重塑中的作用机制;并在基础研究的导向下开展了一系列临床转化研究。通过研究前列腺癌抗雄治疗抵抗和免疫治疗响应率低的分子机制,有望为解决前列腺癌精准诊疗中的“卡脖子”问题提供新的方案。
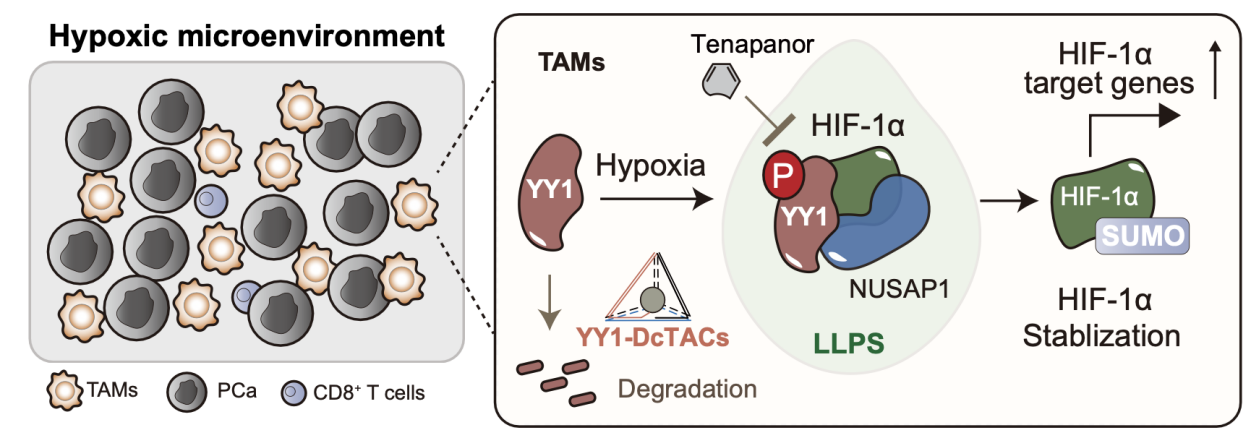
2025年7月7日,湖南大学张定校教授与合作者(东南大学许斌和居胜红教授、中国药科大学马祎教授),在Nature Communications杂志上在线发表题为YY1 enhances HIF-1α stability in tumor-associated macrophages to suppress anti- tumor immunity of prostate cancer in mice的研究论文。该研究揭示了转录因子YY1在TAMs中通过相分离机制稳定HIF-1α进而促进前列腺癌免疫抑制微环境形成的关键作用,并开发了一种可靶向降解巨噬细胞内YY1的新型四面体DNA纳米结构(YY1-DcTACs),显著抑制前列腺癌小鼠模型中的肿瘤生长,并增强 CD8+ T 细胞的肿瘤浸润,为免疫冷肿瘤前列腺癌的免疫治疗提供了新思路。

该研究首先发现了前列腺癌临床样本中YY1+巨噬细胞在肿瘤缺氧区域内浸润增加的现象。进一步的机制研究发现,缺氧可促进YY1酪氨酸磷酸化及其在巨噬细胞核内的液相分离(LLPS)。同时,在巨噬细胞中YY1可通过与NUSAP1的结合,促进 HIF-1α蛋白的SUMO化(抑制其泛素化降解)、相分离和稳定性,从而增强其在缺氧条件下的表达与功能。另外,本研究通过多种方法在小鼠前列腺癌模型中验证了靶向YY1的治疗潜力。一方面,通过小分子药物Tenapanor抑制YY1-NUSAP1-HIF-1α三联体蛋白的相互作用,进而达到抑癌的作用;另一方面,团队开发了一种基于PROTACs靶向降解技术的四面体DNA纳米结构(YY1-DcTACs),特异性地在肿瘤相关巨噬细胞中释放PROTACs和降解YY1蛋白,为前列腺癌的精准治疗提供了新的思路。
本课题为临床问题导向的合作课题,其中东南大学附属中大医院李文超主治医师、陈赛赛博士、陆建副主任医师、毛卫浦副研究员、郑士亚主治医师是本研究的共同第一作者,许斌、马祎、张定校、居胜红教授是本研究的共同通讯作者,东南大学附属中大医院泌尿外科陈明主任和香港大学那溶教授共同指导了本研究的开展。该研究得到多项国家自然科学基金和省部级基金项目的资助。
全文衔接:https://www.nature.com/articles/s41467-025-61560-0