真菌感染对人类健康的威胁日益加剧,全球每年超过150万人因此死亡。唑类药物作为临床一线抗真菌药物,被广泛用于治疗各类真菌感染。然而,随着唑类药物的长期应用,耐药性问题变得愈加紧迫。在病原真菌中,多药耐药转运体介导的唑类药物外排是导致耐药的重要机制之一。以白色念珠菌(最常见的病原真菌)为例,其ABC转运体Cdr1被认为是介导唑类药物耐药的关键因素。尽管白色念珠菌Cdr1的同源蛋白Pdr5的结构已被解析,但Pdr5结合唑类药物的关键结构域仍未被成功捕获,因此外排泵Cdr1如何识别和外排各种唑类药物的机制仍不明了。

米尔贝肟(milbemycin oxime)是一种已被FDA批准用于动物(如猫、狗等宠物)的驱虫剂,其为米尔贝霉素的肟形式化合物。研究显示,唑类药物与米尔贝肟A3/A4组合用于治疗由临床分离的唑类耐药白色念珠菌引起的小鼠全身感染,效果显著。尽管米尔贝肟在细胞和小鼠水平上显示了抑制Cdr1外排泵功能的潜力,但其具体的结合及抑制机制仍不清楚。理解米尔贝肟的抑制机理对于开发针对外排泵Cdr1的新型抑制剂至关重要。
近日,湖南大学生命医学交叉研究院/附属医院严照峰教授团队利用单颗粒冷冻电镜技术,解析了白色念珠菌Cdr1在不同状态下的三种冷冻电镜结构:静息状态(Cdr1Apo)、氟康唑结合状态(Cdr1Flu)、以及米尔贝肟结合状态(Cdr1Mil),其整体分辨率分别为3.38 Å、3.30 Å和3.08 Å。该研究揭示了Cdr1介导氟康唑耐药及米尔贝肟抑制Cdr1外排的分子机制,为未来开发针对Cdr1的抗真菌药物奠定了坚实的理论基础。相关成果以“Cryo-EM structures of Candida albicans Cdr1 reveal azole-substrate recognition and inhibitor blocking mechanisms”为题,于2024年9月6日在线发表于《Nature Communications》杂志。
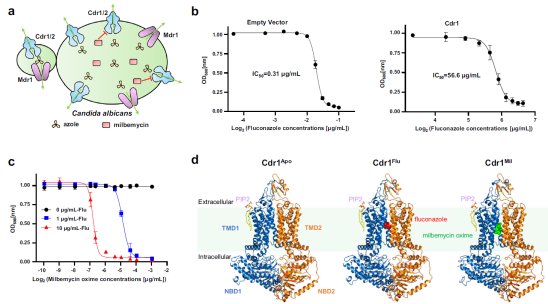
在Cdr1Flu的结构中,TMD1和TMD2包围了一个向细胞内侧开放的空腔,呈现出向内开放的状态。氟康唑结合于该空腔的顶部,由TMD1的TM1、TM2、TM5和TMD2的TM8、TM11环绕,通过疏水作用力、氢键以及范德华力与周围的氨基酸相互作用。对空腔内关键氨基酸残基进行单点或多点突变分析后,发现部分氨基酸突变可以逆转Cdr1对氟康唑的高耐药性表型。与Pdr5AOV结构相比,TM2、TM5、TM8和TM11的构象变化促使氟康唑从结合空腔中排出。
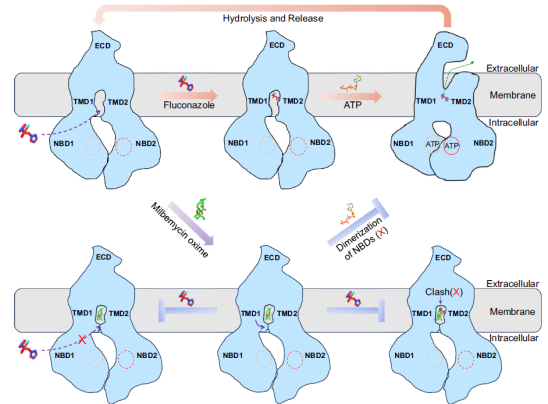
在Cdr1Mil结构中,米尔贝肟与氟康唑共处于相同的结合腔内,但米尔贝肟占据了整个腔体空间,从而导致了两者之间的位阻冲突。同时,米尔贝肟对结合腔的亲和力显著高于氟康唑。此外,米尔贝肟的结合使Cdr1的入口区域关闭,从而阻碍了底物的有效进入。米尔贝肟还显著抑制了Cdr1的ATP酶水解活性,表明其可能作为一种分子胶,阻碍了Cdr1由内向外的构象转变。总体而言,米尔贝肟通过竞争结合位点、阻止底物进入以及阻碍药物外排等多重机制,抑制了Cdr1的功能。基于这些结构和功能研究,作者提出了氟康唑转运与米尔贝肟抑制的模型。
湖南大学博士生彭颖、鹿炎、孙慧,清华大学博士生马金英,山西高等创新研究院工程师李小梅,以及湖南大学硕士生韩晓丹为本文的共同第一作者。湖南大学生命医学交叉研究院/附属医院严照峰教授和尹孟副教授为本文的共同通讯作者。湖南大学附属医院主任医师方志雄、2024届硕士毕业生谭俊明、丘颖琛及屈婷婷也参与了本项研究。本项目得到了国家自然科学基金(32371279、32100972和32200992)、湖南省青年科技人才计划项目(2021RC3046)、湖南省自然科学基金(2023JJ20007、2022JJ40052和2023SK2081)等资助。严照峰教授课题组经费充足,欢迎有志于抗菌药物研究的青年才俊加入课题组从事博士后研究。
全文链接:https://www.nature.com/articles/s41467-024-52107-w