前列腺癌(Prostate cancer, PCa)是威胁中老年男性健康的主因之一。在2024年全球男性肿瘤发病率和死亡率统计中,PCa分别排第二和第五位[1]。雄激素和雄激素受体(Androgen receptor,AR)在PCa的发生发展中起核心作用,故临床上对早期PCa患者主要采取抗雄治疗(Androgen deprivation therapy,ADT)。ADT对原位癌(primary PCa)疗效显著,但对晚期或复发性癌症的疗效有限;而且肿瘤对ADT的耐药性不可避免,几乎所有的病人都会在1-2年内以去势抵抗性前列腺癌(Castration-resistant PCa,CRPC)的形式复发。目前,CRPC在世界范围内基本是不治之症,是晚期PCa患者死亡的主因,其根本原因在于分子机制尚不明确,且对现有的免疫治疗方案不敏感,导致缺乏有效的治疗靶点和策略[2]。
蛋白质精氨酸甲基化是哺乳动物中最常见的翻译后修饰之一,也是近年来备受关注的癌症研究热点;该过程主要由PRMT (protein arginine methyltransferases, PRMTs) 基因家族调控。PRMTs家族共包括9个成员(PRMT1-PRMT9),组织表达谱广泛,可以以3种不同的形式(Ⅰ、Ⅱ和Ⅲ型)对底物进行修饰。研究表明,PRMTs酶活性的改变、基因突变/缺失与癌症的发生发展或/和转移密切相关[3]。作为最主要的Ⅱ型精氨酸甲基化修饰酶,近年尽管有少量研究发现PRMT5在PCa中异常激活,但其在恶性PCa中的确切生物学功能及潜在分子机制尚不清楚,且PRMT5和AR之间是否存在直接调控关系存在明显争议[4]。
近日,湖南大学生命医学交叉研究院的张定校教授团队联合东南大学附属中大医院泌尿科许斌团队,在Cancer Letters (IF=9.756)上在线发表了题为Inhibition of PRMT5 moderately suppresses prostate cancer growth in vivo but enhances its response to immunotherapy的原创性研究论文。该工作揭示了PRMT5通过MYC轴调控PCa恶性生物学行为的分子机制,并通过动物模型证实了靶向PRMT5联合免疫治疗是治疗CRPC新的可行方案。

首先,作者利用临床组织样本结合公共数据库,确认了PRMT5在肿瘤组织中的上调表达,并发现其与病人的不良预后相关。细胞生物学试验表明,利用shRNA降低PRMT5的表达水平或利用小分子抑制剂EPZ015666(PRMT5i)特异性地抑制其酶活性后,肿瘤细胞的增殖、侵袭、干性(stemness)等多种恶性生物学行为均受到显著抑制;且随着细胞恶性程度的升高,其受到的影响也更加明显。分子机制方面,作者利用不同处理条件下的RNA-seq、Cut&Tag和公共数据分析发现,PRMT5可以促进cancer-promoting相关通路(如增殖、DNA损伤修复、干性等)进而发挥促癌功能。鉴于AR在PCa发生发展中的核心角色,作者全方位探究了PRMT5与AR之间的关系,证实两者之间并不存在直接的调控作用。而与之相对应的,PRMT5与核心致癌因子MYC组成强烈的正反馈调控轴。
PCa是典型的“冷”肿瘤,免疫细胞浸润水平低,导致病人对免疫治疗应答率低。作者发现PRMT5对PCa的免疫活性起负调控作用,由此设想:能否通过抑制PRMT5活性提升肿瘤整体免疫水平,将其由“冷”变“热”,再进行免疫治疗,对肿瘤细胞进行有效杀伤?为此,作者利用NSG、RM1和TRAMP等系列小鼠模型,分别检测PRMT5i、anti-PD-1单药和联合用药对肿瘤的抑制效果。结果显示,PRMT5i和anti-PD-1单药处理仅能较弱地抑制体内肿瘤的生长,而双药连用则展现出更佳的抑癌作用(A)。最后,由于PRMT5i单药的作用较温和,那它是否能和其他现有的一些癌症治疗药物联合使用,增加药效?受合成致死概念的启发,作者利用全基因组CRISPR/Cas9筛选技术,挖掘了一系列潜在和PRMT5起协同效应的治疗靶标(B),比如PRMT5i可以显著增强PARPi对CRPC癌细胞的杀伤效果(值得后续进一步的预临床和临床研究)。
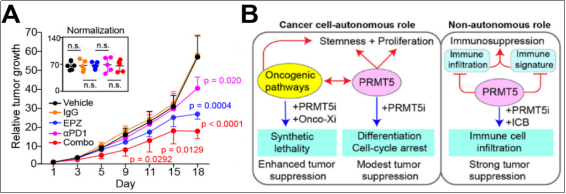
该项研究中,作者利用生信分析和细胞/分子生物学手段,全方位探究了PRMT5对肿瘤细胞的调控作用,并揭示了3种以靶向PRMT5为核心的潜在治疗CRPC的方案:1)PRMT5i可通过抑制cancer-promoting相关通路对肿瘤细胞的恶性表型起一定的抑制作用;2)PRMT5i联合免疫治疗可对肿瘤产生显著杀伤;3)PRMT5i联合靶向其他肿瘤协同因子药物可进一步提升抗肿瘤效果(B)。因此,作者为明晰PRMT5在PCa中的功能和分子机制提供了新的认知,为其潜在的临床应用提供了理论和试验基础(已有不同公司的多款PRMT5i在进行临床试验)。
张定校实验室的博士生贺琴菊、张元祯,东南大学许斌团队李文超医师和博士生陈赛赛为论文的共同第一作者。张定校教授、博士后邹成和东南大学许斌教授为论文共同通讯作者。该工作受到了中南大学湘雅医院袁凯教授的大力支持!课题组长期招收保研生和直博生,并热忱欢迎具有生命医学背景的博士后加盟!
全文衔接:https://www.sciencedirect.com/science/article/pii/S0304383524006098
参考文献:
1. Siegel RL, Giaquinto AN, Jemal A: Cancer statistics, 2024. CA: a cancer journal for clinicians 2024, 74(1):12-49.
2. Zhang D, Zhao S, Li X, Kirk JS, Tang DG: Prostate Luminal Progenitor Cells in Development and Cancer. Trends in cancer 2018, 4(11):769-783.
3. 何伶靖, 邹成, 贺琴菊, 冯宇晴, 张定校. PRMT5在癌症中的研究进展. 中国细胞生物学学报 2021, 43 (03).
4. Qinju He, Yuanzhen Zhang, Wenchao Li, Saisai Chen, Jiangling Xiong et al.: Inhibition of PRMT5 moderately suppresses prostate cancer growth in vivo but enhances its response to immunotherapy. Cancer Letters 2024, 31:602:217214.