前列腺癌(Prostate cancer, PCa)是威胁中老年男性健康的主因之一。在2024年全球男性肿瘤发病率和死亡率统计中,PCa分别排第二和第五位[1]。雄激素和雄激素受体(Androgen receptor, AR)在PCa的发生发展中起核心作用,故临床上对早期PCa患者主要采取抗雄治疗(ADT)。ADT对原位癌(primary PCa)疗效显著,但癌症复发不可避免,几乎所有的患者都在1-2年内以去势抵抗性前列腺癌(CRPC)的形式复发并转移[2]。虽然绝大多数PCa 主要表现为管腔腺癌(Luminal phenotype adenocarcinoma),但在肿瘤发生发展过程中和临床药物的压力下,癌细胞的谱系可塑性(cell lineage plasticity)增强,会导致多种亚型的产生[3]。CRPC包含多种恶性亚型,比如AR—神经内分泌性PCa(NEPC),大细胞(Large-cell)PCa、AR—小细胞PCa(SCPC)、同时表达NE 标志物和AR的AMPC(amphicrine carcinoma)、以及AR-null和NE-null的双阴性PCa(DNPC)等[4]。目前,CRPC在世界范围内基本是不治之症,是晚期PCa患者死亡的主因,其根本原因在于其分子机制尚未完全阐明,导致有效治疗靶点和方案的缺乏。

前列腺癌具有较高的病理学和细胞学异质性。近日,湖南大学生命医学交叉研究院的张定校团队联合东南大学附属中大医院许斌团队,在Science Advances上在线发表了题为Identification of an anaplastic subtype of prostate cancer amenable to therapies targeting SP1 or translation elongation的原创性研究论文。该工作发现了一类新的恶性小细胞样(small-cell like)PCa亚型(SCLPC),并实验验证了靶向蛋白质合成通路和转录因子SP1是治疗SCLPC的潜在可行方案。
作者利用空间结合单细胞核转录组学,对8例未经治疗的PCa临床样本展开研究,解析了从正常à原位癌à恶性PCa多个不同肿瘤时期的病理学异质性。有趣的是,除了典型的腺癌,作者还发现了一种类似小细胞癌的PCa亚型(SCLPC)。SCLPC具有高增殖能力和高干性(Stemness)的特征;且其转录组标签(Transcriptome signature)与已报道的PCa亚型均不相同,生信分析提示多个致癌通路在SCLPC中被激活(如WNT和RB1下游的CDK4/6等)。值得注意的是,原发性的小细胞PCa亚型在临床上十分少见。为进一步挖掘不同恶性PCa亚型的驱动基因和分子信号通路,作者将其与相对惰性的原位癌进行了多维度地比较,发现SCLPC对蛋白质合成通路(Protein biosynthesis)和转录因子SP1有偏好性依赖,提示靶向这两者的活性可能是新的治疗恶性PCa的临床策略。
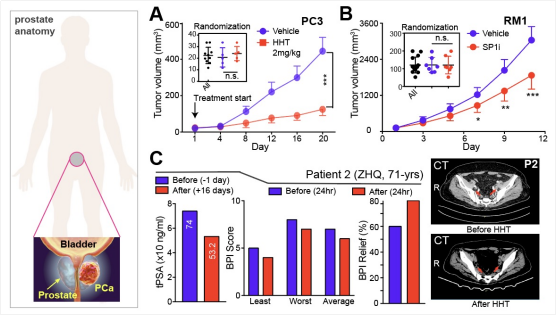
对此,作者选用了目前 唯一一款被FDA批准的小分子翻译延伸抑制剂 HTT(目前用于治疗慢性髓系白血病)和 P licamycin (SP1特异性抑制剂)来分别处理PCa细胞,结果表明肿瘤细胞的各种恶性生物学行为(包括增殖、迁移、侵袭和干性等)均受到显著抑制。对于体内试验,作者选用了具有s mall cell-like PC3异种移植瘤和A R- independent CRPC RM1同种移植瘤。体内药物治疗试验结果表明,HTT和P licamycin 处理均能显著抑制体内肿瘤的生长(图 A 和图 B ),证明了它们是潜在的治疗策略。为更进一步证明本研究的临床相关性,作者选取HTT(目前唯一被FDA批准可用于临床的蛋白质翻译抑制剂)进行了 研究者发起的临床试验 (i nvestigator- i nitiated t rials , IIT),结果显示单次剂量的HTT给药可有效降低激素治疗后抵抗CRPC病人的PSA水平和缓解病人的癌痛,并且抑制转移病灶的恶性进展和扩散(图 C )。作者在该IIT中招募了多名患者,其肿瘤负荷均得到了有效的控制,说明HTT是治疗CRPC的一个可行方案。
该工作从临床样本出发,鉴定了一种新的恶性PCa亚型,并通过多种体内外试验证明靶向蛋白质合成通路和SP1可有效地抑制肿瘤进展。尤其是作者开展了IIT临床研究,初步证明了HTT治疗恶性PCa的可行性,为后续临床转化提供了直接的依据。
湖南大学张定校团队博士后邹成,博士生张元祯(博二),和东南大学附属中大医院李文超医师为论文共同第一作者,东南大学附属中大医院许斌主任和湖南大学张定校教授为论文的共同通讯作者。此外,广东药科大学的李雄教授对本研究做出了建议和帮助。该研究得到国家自然科学基金、湖南省自然科学基金等项目的资助。
全文衔接:https://www.science.org/doi/10.1126/sciadv.adm7098
张定校教授团队主要围绕癌症基因组学、前列腺癌干细胞和肿瘤靶向治疗开展研究,近年来以通讯作者的身份先后在Sci Adv (2024), Oncogene (2024), GPB (2024), JITC (2023), Nat Commun (2020, 2016), Stem Cell Rep (2018), Stem Cells Transl Med (2017)等国际学术期刊上发表系列研究成果,并受邀在JHO (2021), CMLS (2020), Trends Cancer (2018), Semin Cancer Biol (2018) 等知名期刊发表通讯作者综述。课题组长期招收博士后和博士研究生,并热忱欢迎助理教授和副教授的加盟(湖南大学提供正式的编制)。
1. Siegel RL, Giaquinto AN, Jemal A: Cancer statistics, 2024. CA: a cancer journal for clinicians 2024, 74(1):12-49.
2. Zhang D, Zhao S, Li X, Kirk JS, Tang DG: Prostate Luminal Progenitor Cells in Development and Cancer. Trends in cancer 2018, 4(11):769-783.
3. Zhang D, Hu Q, Liu X, Ji Y, Chao HP, Liu Y, Tracz A, Kirk J, Buonamici S, Zhu P et al: Intron retention is a hallmark and spliceosome represents a therapeutic vulnerability in aggressive prostate cancer. Nature communications 2020, 11(1):2089.
4. Zou C, Li W, Zhang Y, Feng N, Chen S, Yan L, He Q, Wang K, Li W, Li Y et al: Identification of an anaplastic subtype of prostate cancer amenable to therapies targeting SP1 or translation elongation. Science advances 2024, 10(14):eadm7098.